11月5日,基础医学院于晓、孙金鹏教授团队,联合中国科学院上海药物研究所徐华强、赵丽华团队,浙江大学基础医学院张岩团队等在Nature Communications杂志在线发表了题为 “Structure insights into selective coupling of G protein subtypes by a class B G protein-coupled receptor”的研究成果,系统性阐述了促肾上腺皮质激素释放因子受体偶联Gs、G11和Go蛋白的分子作用机制,奠定了B类GPCRs的G蛋白选择性偶联激活机制研究基础。于晓教授,合作者徐华强研究员、赵丽华研究员和张岩研究员为论文的共同通讯作者,基础医学院博士研究生林婧宇为论文的共同第一作者,参与该项工作的还有于晓和孙金鹏教授团队的肖鹏教授。
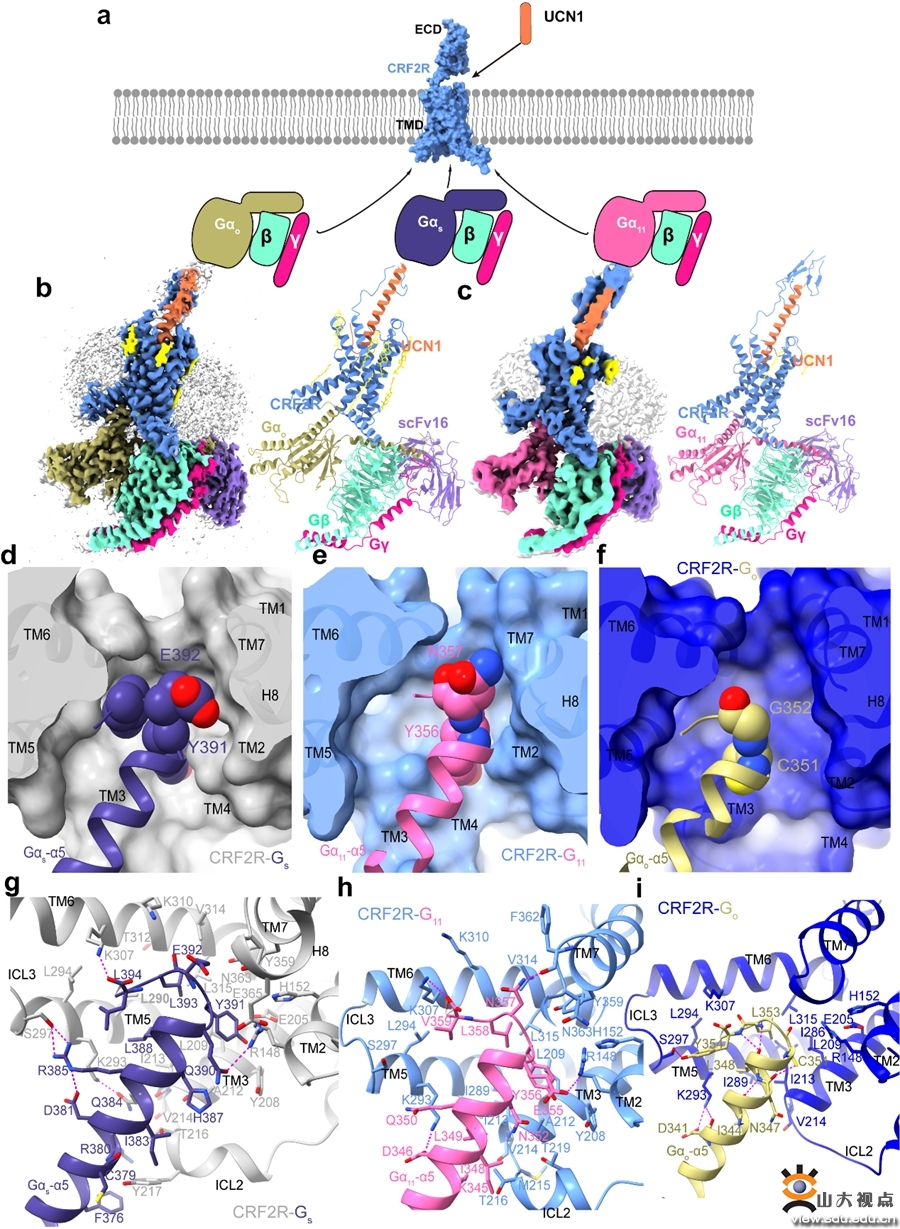
CRF2R与不同G蛋白偶联的冷冻电镜结构以及对G蛋白选择性偶联分子机制
胰岛含有多种类型的内分泌细胞,不同类型细胞之间组成紧密精细的胰岛环路,共同维持胰岛的稳态和生理功能。于晓和孙金鹏团队于2018年在Cell Death Dis发表文章,发现在胰岛中特异性敲除δ细胞会造成小鼠血糖代谢紊乱并最终引发小鼠围产期死亡,为δ细胞在葡萄糖稳态控制中的功能重要性提供了直接证据。同时,于晓/龚瑶琴/孙金鹏团队于2017年在J Clin. Invest.发表文章,发现胰岛β细胞分泌的UCN3通过激活胰岛δ细胞上的CRF2R,构成胰岛内源性细胞环路的UCN3-CRF2R信号轴,通过调控CUL4B/PRC2表观遗传复合物来维持胰岛功能稳态,不正常的阻断胰岛内源性UCN3-CRF2R这条通路会导致糖尿病的发生,而UCN3-CRF2R下游与G蛋白亚型偶联的机制和功能尚不清楚。徐华强/赵丽华/张岩团队于2020年在Molecular Cell发表CRF1R和CRF2R在内源性配体UCN1激活下分别与Gs蛋白三聚体复合物的高分辨三维结构,揭示了配体识别不同受体的特异性机制。在此前基础上,本研究系统性阐述了CRF2R偶联Gs、G11和Go蛋白的分子作用机制,奠定了B类GPCRs的G蛋白选择性偶联激活机制研究基础。
研究团队利用单颗粒冷冻电镜技术分别解析了分辨率为2.8Å和3.7Å的UCN1-CRF2R-Go和UCN1-CRF2R-G11复合物结构(图1a-c),比较了不同G蛋白(Gs,Go和G11)在CRF2R中结合界面的面积大小以及Gα的α5螺旋的C末端氨基酸侧链大小,比较发现C末端氨基酸Gs蛋白中的侧链最大,与受体形成的结合面积最大,相互作用也最多,其次是G11蛋白,最后是Go蛋白,这与B类GPCRs偶联不同G蛋白的能力一致,揭示了Gα的α5螺旋的C末端在CRF2R选择性偶联不同G蛋白中起着决定性作用。该结果更好地解释B类GPCRs家族中经典信号通路Gs蛋白偶联的分子基础,同时也填补了B类GPCRs在G11,Go信号通路的机制方面的研究空白。
于晓教授课题组长期聚焦于胰岛稳态的作用及调节机制,阐明了跨膜信号转导对胰岛β细胞分泌功能及胰岛稳态的精确调控机制,包括GPCR下游偏好性信号途径和第二信使的信号时序等(Cell Metabolism 2022, Nature 2020,EMBO Reports 2021,eLife 2018,Nature Commun 2021);揭示了胰岛中δ-β细胞环路在胰岛稳态维持中的重要作用(J Clin Invest. 2017,Cell Discov. 2020,Cell Death Dis. 2018);开发了选择性调节G蛋白偶联受体和PEST磷酸酶亚家族活力来对胰岛稳态失衡发展新的干预策略(Cell 2021,PNAS 2021,Cell Research 2014,Cell Reports 2016)等。本研究得到国家重点研发计划基金、国家自然科学基金的支持。
文章链接:
https://www.nature.com/articles/s41467-022-33851-3