近日,药学院刘新泳/展鹏教授团队在药物化学领域国际顶尖期刊Journal of Medicinal Chemistry发表了题为“Discovery and Crystallographic Studies of Trisubstituted Piperazine Derivatives as Non-Covalent SARS-CoV-2 Main Protease Inhibitors with High Target Specificity and Low Toxicity”及“Discovery and Crystallographic Studies of Nonpeptidic Piperazine Derivatives as Covalent SARS-CoV-2 Main Protease Inhibitors”的两篇研究论文。药学院博士后高升华为两篇论文第一作者,研究生宋乐天为第二篇文章的共同第一作者。学院刘新泳教授、展鹏教授,德国波恩大学Christa E Müller教授、美国圣路易斯大学Ann E. Tollefson教授为论文的共同通讯作者。该研究部分化合物的合成得到山东齐都药业有限公司张涛的大力帮助。该系列研究成果已被中华医学大会2022医学病毒学大会等收录,并在山东省研究生药学学术创新论坛中获得创新项目特等奖。

新型冠状病毒感染(COVID-19)规模持续扩大,SARS-CoV-2的传播仍然严重威胁着人类的生命健康。疫苗作为重要的防治手段,缓解了大流行带来的重症风险,但自Omicron以来的多种变异株通过免疫逃逸作用降低了其有效性,也促使科学家继续寻找新的治疗手段来对抗病毒的耐药性问题。小分子药物可以作用于病毒入侵人体细胞的各个环节,受变异株影响相比于疫苗或抗体要小得多,因此具有广谱、持续的抗冠状病毒潜力。加之运输便利、给药方式便捷、易于扩产降本等多种优势,在新冠治疗领域具有广阔的应用前景。随着《新型冠状病毒肺炎防控方案(第九版)》的发布,疫情防控措施逐渐调整。缓解症状的解热镇痛药物及各类中成药成为轻症感染者应对疫情的两大“法宝”。而直接靶向新冠病毒的有效药物是老年人、重症患者以及受基础病困扰的人群的迫切需求。
主蛋白酶(main protease,Mpro或3CLpro)在SARS-CoV-2生命周期中发挥重要作用。其结构在变异株中高度保守,是开发抗SARS-CoV-2小分子药物的理想靶标。在已经批准上市的复方药物帕罗韦德(Paxlovid)中,肽类共价抑制剂奈玛特韦必须与P450酶抑制剂利托那韦协同用药,与其他药物联合使用时的风险无法避免;而在日本上市的非共价抑制剂Ensitrelvir则有潜在的致畸风险。因此进一步开发高活性、低毒性、疗效确切的主蛋白酶抑制剂成为保障人民生命健康的重要手段。
近日,刘新泳/展鹏教授团队与德国波恩大学Christa E Müller教授团队合作,将结构生物学技术与药物化学策略紧密结合,设计合成了多个系列的1,2,4-三取代哌嗪类主蛋白酶抑制剂。本研究首先通过分析蛋白质数据库中主蛋白酶与小分子片段共晶的结构生物学信息,综合运用基于靶标的精准药物设计及优势片段聚焦型化合物库的构建,在哌嗪环上引入多种侧链,以期最大程度占据主蛋白酶活性空腔的多个位点,并与关键残基形成额外氢键作用,提高抗病毒活性。本研究形成了计算机辅助药物设计指导下的多层级结构优化方法,兼顾目标分子的活性与成药性,具有推广价值。
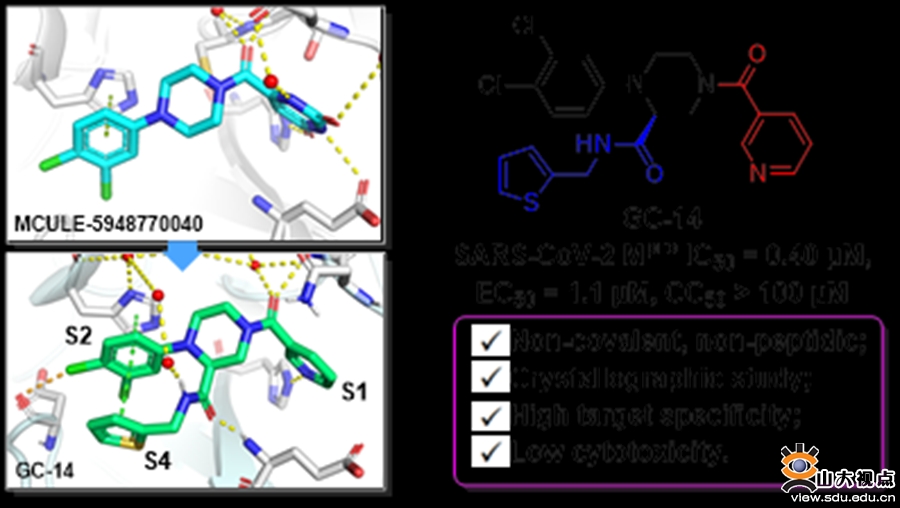
非共价结合型主蛋白酶抑制剂GC-14的发现
活性筛选实验发现,目标化合物GC-14对SARS-CoV-2 Mpro有较强的抑制作用(IC50= 0.40 μM),同时在Vero E6细胞系中展现出了优异的抗新冠病毒活性(EC50= 1.0 μM),是上市药物瑞德西韦(EC50= 2.27 μM)2倍左右。值得注意的是,GC-14的细胞毒性极低(CC50>100 μM)。此外,GC-14对SARS-CoV-2 Mpro具有良好的靶标选择性(对人组织蛋白酶B、F、K和L以及半胱天冬酶3的IC50> 50 μM),有望克服目前临床开发的拟肽类抑制剂存在的脱靶作用。大鼠体内药代动力学结果显示GC-14体内半衰期为1.73 h,口服生物利用度F= 7.2%(图1)。结构生物学研究表明,GC-14结合Mpro时,其哌嗪骨架新引入的酰胺基团与关键氨基酸残基Glu166形成了稳定的氢键作用。出乎意料的是,噻吩甲胺侧链与S2空腔中的二氯苯基以及His41咪唑环形成了独特的“三明治”堆积结构,增强了与靶标的亲和力。
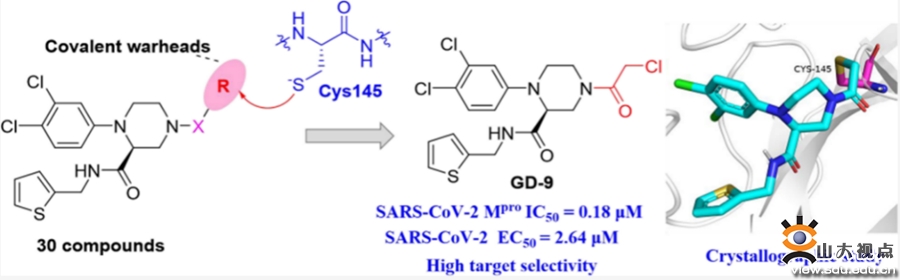
共价结合型主蛋白酶抑制剂GD-9的发现
相对非共价抑制剂来说,共价抑制剂具有作用较强并且持久,给药剂量以及给药频率减少等特点,能够通过靶向特定关键残基,达到提高抗耐药性及靶标选择性等优点。鉴于此,通过结构生物学指导的定点靶向(Cys145),设计合成了另一系列哌嗪类共价抑制剂,其中化合物GD-9对Mpro具有更高的的抑酶活性(IC50= 0.18 μM),同时展现出了良好的抗SARS-CoV-2效力(EC50= 2.64 μM),与瑞德西韦活性相近。GD-9与主蛋白酶的共价结合分别通过酶动力学实验(kinac/Ki= 21500 M-1s-1),时间依赖性实验及MALDI-TOF/TOF-MS得到了验证。同样,相比于人半胱氨酸蛋白酶,GD-9对SARS-CoV-2 Mpro具有良好的靶向选择性(对组织蛋白酶B、F、K和L以及半胱天冬酶3的IC50> 30 μM)。相比于GC-14的共晶结构,化合物GD-9与Cys145的共价连接导致哌嗪骨架构象产生翻转,侧链噻吩甲胺基团出现了显著的位移,对分子整体构象形成了“牵一发动全身”的效应(图2)。尽管如此,GD-9仍通过与Mpro的多重非共价作用,来发挥高活性及良好靶标选择性。
总体来讲,以上两类非肽类Mpro抑制剂均展现出了优异的抗SARS-CoV-2活性及高靶标选择性。结构生物学研究揭示了代表性分子与主蛋白酶的独特结合模式,可为进一步的抗新冠药物研发提供结构基础。GC-14是值得研发的结构新颖的候选分子,目前已申请中国发明专利(CN114409643B),后续开发有望为新冠病毒感染者的临床用药提供更多选择。
该研究工作是刘新泳/展鹏教授团队多年来抗病毒药物研究工作的延续与拓展,得到了国家自然科学基金、科技部高端外国专家引进计划、山东省自然科学基金重大基础研究项目、山东省重大科技创新工程等项目的资助。该研究还得到泰山学者计划(特聘教授)和教育部长江学者奖励计划(青年学者)、山东省杰出青年基金(抗病毒药物化学)等人才项目的支持。
原文链接:
1.Discovery and Crystallographic Studies of Trisubstituted Piperazine Derivatives as Non-Covalent SARS-CoV-2 Main Protease Inhibitors with High Target Specificity and Low Toxicity
2.Discovery and Crystallographic Studies of Nonpeptidic Piperazine Derivatives as Covalent SARS-CoV-2 Main Protease Inhibitors