近日,齐鲁医院放射科于德新教授、高至亮助理研究员与山东大学化学与化工学院崔基炜教授团队合作,围绕STING通路激活与肿瘤免疫联合治疗取得了系列研究成果,先后发表在生物材料领域高水平期刊ACS Nano(中科院1区,IF=15.8)、Chemical Engineering Journal(中科院1区,IF=13.3)。
cGAS-STING通路作为先天免疫反应中的重要组成部分,能感知细胞内dsDNA启动通路激活并有效释放促炎细胞因子,增强树突状细胞抗原呈递能力,继而增加细胞毒性T细胞浸润以实现抗肿瘤作用。尽管如此,肿瘤微环境中的低免疫原性和STING通路的有限持久激活效率仍阻碍疗效的提高。
基于此,研究团队针对性地设计了多种途径增效STING通路激活程度,提高抗肿瘤免疫治疗疗效。
成果1:
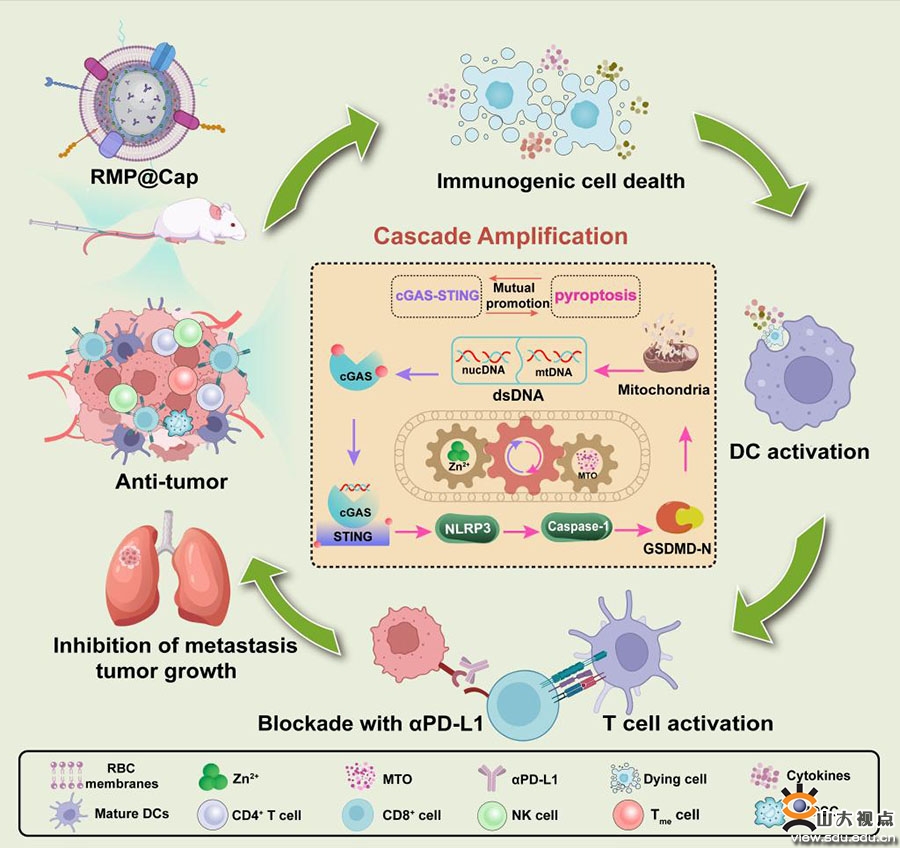
焦亡作为一种新兴细胞程序性死亡形式,能够有效释放肿瘤抗原增强肿瘤免疫原性。同时,最新研究发现焦亡可以触发早期焦亡相关的线粒体损伤和mtDNA释放,增加细胞内dsDNA含量。基于此,研究团队构建了一种双通路激活的纳米胶囊,成功实现焦亡诱导及cGAS-STING通路激活,并探索验证了二者间的循环级联放大效应,为增强肿瘤免疫治疗疗效提供了新的思路与方法。研究成果“Metal-Phenolic Vehicles Potentiate Cycle-Cascade Activation of Pyroptosis and cGAS-STING Pathway for Tumor Immunotherapy”发表在ACS Nano上,于德新教授、崔基炜教授、高至亮助理研究员为论文的共同通讯作者,齐鲁医院放射科博士研究生孙伟凯为论文第一作者,山东大学为第一作者和唯一通讯作者单位。
成果2:
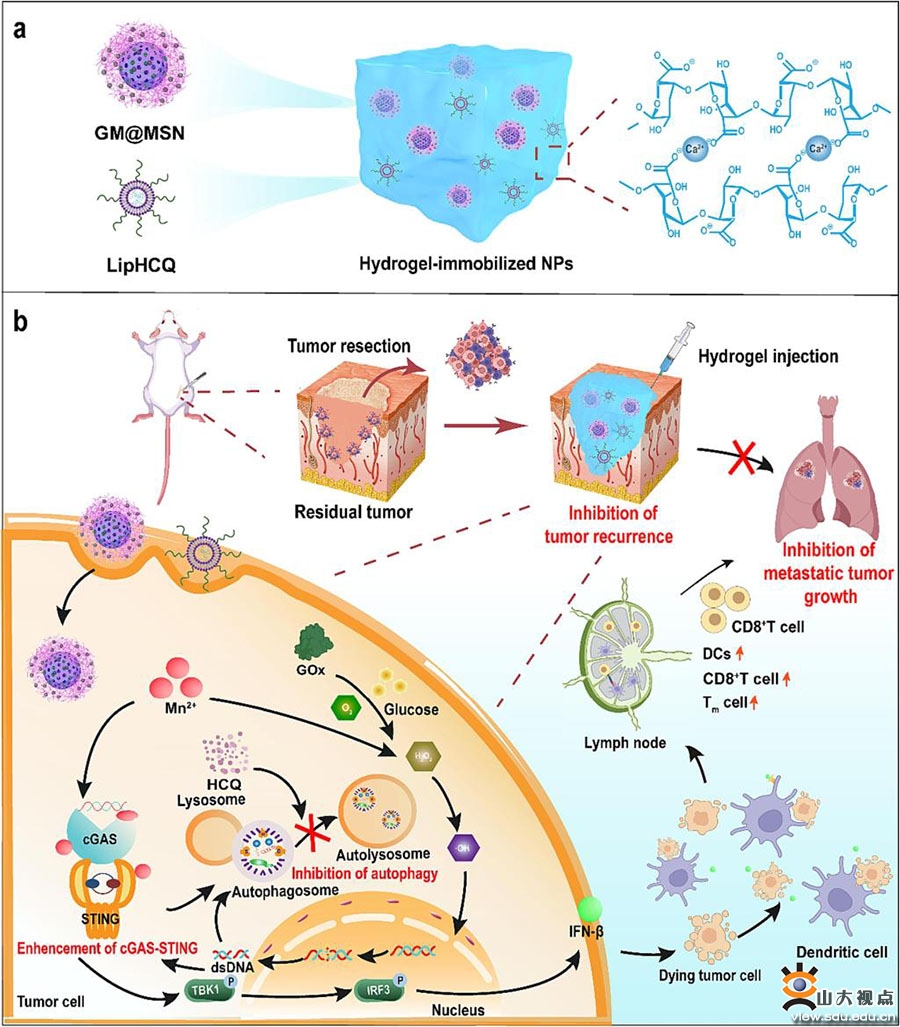
研究团队发现,肿瘤细胞在应对cGAS-STING信号通路的激活时亦触发了其内部的保护性自噬。自噬的激活又会导致STING降解,对STING的激活起“刹车”作用以限制其免疫激活能力。此外,自噬还可以通过降低应激反应,阻止ROS积累,避免肿瘤细胞氧化应激损伤,从而促进肿瘤生长。基于此,研究团队搭建了一种可局部注射水凝胶,通过Mn2+发挥STING激活作用并实现肿瘤诊疗一体化,联合自噬抑制最终进一步提升cGAS-STING通路激活而显著改善免疫治疗效果。研究成果“Hydrogel-immobilized nanotherapeutics: inhibition of protective autophagy to amplify STING for postsurgical tumor immunotherapy”发表在Chemical Engineering Journal上,于德新教授、崔基炜教授、高至亮助理研究员为论文的共同通讯作者,齐鲁医院放射科博士研究生王红为论文第一作者,山东大学为第一作者和唯一通讯作者单位。
以上系列研究工作得到了国家自然科学基金,山东省自然科学基金等项目的资助。同时得到了齐鲁医院基础医学研究中心、山东省零磁医学与功能成像重点实验室、国家医工交叉学科产教融合创新平台、山东大学纳米分子与功能成像转化医学研究中心等平台的大力支持。